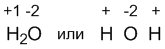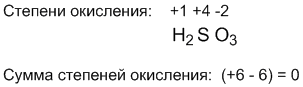Довольно просто определять степень окисления в ионных соединениях, где сразу видно, откуда и куда перешли электроны. Из табл. 3-4 видно, что знак и величина степени окисления всегда совпадают со знаком и зарядом одноатомных ионов.
Степень окисления магния составляет +2, а степень окисления кислорода составляет –2. Точно так же в соединении CaCl2 степень окисления кальция +2, а степень окисления хлора –1.
Сложнее обстоит дело с полярными ковалентными соединениями. Здесь на помощь приходит знание относительной электроотрицательности элементов. Например, в молекуле воды Н2О кислород более электроотрицателен, чем водород, поэтому электроны связей смещены в сторону кислорода. Если бы вода была ионным соединением, то ее формулу можно было бы записать так:
Здесь степени окисления - это условные заряды атомов в молекуле, если считать, будто бы это ионная, а не полярная ковалентная молекула. Тогда степень окисления кислорода в воде составляет -2, а степень окисления водорода +1.
Кому-то из вас может показаться, что степень окисления – это та же валентность, но только со знаком "+" или "–". На самом деле это не всегда верно. Давайте посчитаем степень окисления в другом соединении водорода и кислорода – перекиси водорода Н2О2. Структурная и гипотетическая “ионная” формулы этого вещества выглядят так:
Второй заряд "–" не может появиться на атоме кислорода потому, что кислород не в состоянии оттянуть электроны от своего соседа – точно такого же атома кислорода. Вывод: степень окисления кислорода в этом соединении составляет –1 (хотя его валентность по-прежнему II). Степень окисления водорода составляет +1.
Степень окисления и валентность несут разную информацию об атоме в его соединениях. Валентность просто характеризует способность атома образовывать некоторое количество химических связей, а степень окисления описывает смещения электронов при образовании химических связей.
Итак, уточним определение степени окисления с учетом всего того, что было сказано о ковалентных соединениях:
СТЕПЕНЬ ОКИСЛЕНИЯ выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении.
Если атом отдал электроны, его степени окисления приписывается знак “+”, а если атом принял электроны, то знак “–”. Возможна и нулевая степень окисления атома в молекуле, если электроны никуда не смещались или число отданных и принятых электронов одинаково.
Степень окисления – очень важная величина, относящаяся к основным понятиям химии. Фактически, степень окисления описывает состояние атома в соединении.
Есть несколько полезных правил, которые касаются степеней окисления:
1) Степень окисления атома любого элемента в свободном состоянии равна нулю.
Это связано с тем, что в чисто ковалентных двухатомных молекулах электроны не смещены ни к одному из атомов. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю. Примеры молекул, где степени окисления атомов равны нулю: H2, Fe, F2, Na, O2, N2, Ar.
2) Степень окисления любого простого одноатомного иона равна его заряду. Примеры:
H+ (+1),
Fe3+ (+3),
F– (-1),
Na+ (+1).
3) Степень окисления водорода в его соединениях с другими элементами равна +1.
Примеры молекул, где водород имеет степень окисления +1: H2O, NH3, CH4, HF, HCl. Исключение составляют довольно редкие соединения - гидриды металлов (например, LiH), в которых степень окисления водорода равна –1, потому что электроотрицательность металлов меньше, чем у водорода.
4) Степень окисления кислорода равна -2 во всех соединениях, где кислород не образует простой ковалентной связи О—О.
Примеры молекул, где кислород имеет степень окисления –2 (таких соединений кислорода – подавляющее большинство): H2O, SO2, SO3, NO2. Положительную степень окисления кислород проявляет только в соединениях с фтором (например, в соединении OF2, где степень окисления кислорода равна +2).
5) Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю.
6) Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
Эти правила полезны во многих случаях. Посмотрите, например, как c их помощью легко определяется степень окисления элемента с переменной (или неизвестной) валентностью по молекулярной формуле. Допустим, имеется соединение H2SO3. Спрашивается, какова степень окисления серы? Поскольку степень окисления водорода всегда (+1), а степень окисления кислорода (–2), то нетрудно подсчитать, что положительные и отрицательные степени окисления "уравновесят" друг друга в молекуле H2SO3 тогда, когда степень окисления серы составит (+4). В этом случае алгебраическая сумма всех степеней окисления в молекуле равна нулю:
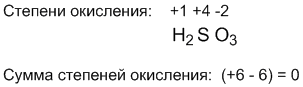
Действие этого правила можно показать и на примере реакции серы с кислородом, в которой электроны формально переходят от одного атома к другому:

До реакции сера и кислород имели одинаковую – нулевую степень окисления. В результате реакции степень окисления серы повысилась (+4). Значит, сера окислилась.
Степень окисления кислорода понизилась (-2), то есть кислород восстановился. Алгебраическая сумма всех степеней окисления в SO2 осталась равной нулю.
Подобных реакций с изменением степеней окисления реагирующих атомов – огромное множество. Все вместе они называются окислительно-восстановительными реакциями.
В последующих главах мы рассмотрим эти реакции подробнее, а пока еще раз разберемся в новых терминах.
Просто так трудно запомнить, какой процесс – отдачи или захвата электронов – называется окислением, а какой – восстановлением. Какой атом приобретает отрицательную, а какой – положительную степень окисления.
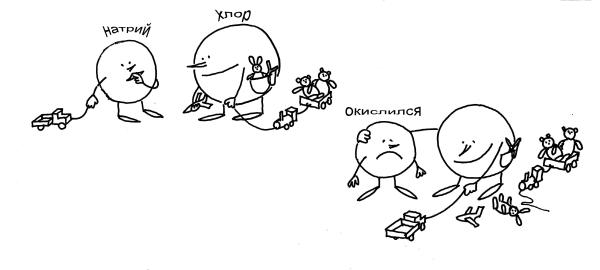
Рис. 3-11. Не совсем обычная запись уравнения химической реакции: Na + Cl = NaCl (см. текст). Хлор – "отрицательный", он отбирает чужие электроны. Натрий "окислился" – это заметно по его кислой физиономии.
Кому-то из вас поможет рис. 3-11, который рассказывает о реакции между натрием и хлором так, как будто это случилось в "химическом детском саду". В этом “детском саду” порядки такие же, как и в обычном. У Хлора целых 7 игрушек (электронов). Натрию же достался только грузовичок (1 электрон). Тут Хлор увидел у Натрия грузовичок и решил, что именно этой игрушки ему и не хватает! Хлор посильнее, поэтому грузовичок мгновенно оказался у него. А чтобы Натрий не ябедничал (у него такой окислившийся вид!), Хлор предложил поиграть вместе. Какое там! Конечно же, все 8 игрушек Хлор подтащил поближе к себе, а Натрию только и остается, что стоять рядом с “окисленным” видом.
Итак, какова мораль? Хлор, конечно, отрицательный. Он отобрал чужую игрушку-электрон. Теперь у него отрицательная степень окисления. Натрий, безусловно, окислился - вон какой у него “кислый” вид. Но и от Хлора не отходит - игрушек-то больше нет! Чем не картина образования химической связи в типичной окислительно-восстановительной реакции?
Остается только добавить, что восстанавливается в таких реакциях окислитель, а окисляется – восстановитель. В нашей истории хлор – окислитель, а натрий – восстановитель.
 Точно так же реагирует с хлором-окислителем металлический калий (востановитель). У калия еще легче "отобрать" электрон, чем у натрия, поскольку его внешняя электронная оболочка находится дальше от ядра. Реакция протекает с выделением белого "дыма" - кристаллов соли KCl (посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов").
Точно так же реагирует с хлором-окислителем металлический калий (востановитель). У калия еще легче "отобрать" электрон, чем у натрия, поскольку его внешняя электронная оболочка находится дальше от ядра. Реакция протекает с выделением белого "дыма" - кристаллов соли KCl (посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов").
Задачи.
3.25. Пользуясь таблицей электроотрицательностей элементов и правилами для определения степеней окисления, определите степени окисления всех атомов в следующих молекулах: HClO4, HClO3, HClO2, HClO, HCl, Cl2, NH3, PH3, H3PO4, O2, O3.
 Например, при взаимодействии магния с кислородом образуется ионное соединение Mg2+O2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов" – горение магния в кислороде.
Например, при взаимодействии магния с кислородом образуется ионное соединение Mg2+O2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов" – горение магния в кислороде.