
§4.1 Электронные оболочки атомов и Периодический закон.
Теперь, когда мы умеем составлять электронные формулы самых разных элементов и знаем основные типы химической связи, можно сравнить элементы между собой и выбрать среди них те, которые проявляют похожие химические свойства.
О каких свойствах пойдет речь? Это может быть валентность, степень окисления, тип химической связи, формулы соединений с водородом и кислородом, окислительные и восстановительные свойства.
Мы уже знаем, что химические свойства элемента определяются его внешней электронной оболочкой. Поскольку именно эти внешние электроны ответственны за образование связей с другими атомами, такие электроны называются валентными электронами.
Выберем среди элементов те, которые имеют похожие валентные оболочки. Для этого заглянем в таблицу электронных конфигураций элементов (с 1 по 36).
Водород Н (заряд ядра Z=1) имеет валентную оболочку 1s1. Аналогичную валентную оболочку – только на более далеком от ядра уровне 2s1 – имеет элемент литий Li (Z=3). Валентную оболочку 3s1 имеет элемент натрий Na (Z=11), валентную оболочку 4s1 – элемент калий K (Z=19), оболочку 5s1 – рубидий Rb (Z=37), оболочку 6s1 – цезий Cs (Z=55) и, наконец, самую удаленную от ядра валентную оболочку такого типа 7s1 имеет элемент франций Fr (Z=87) – таблица 4-1.
Таблица 4-1. Одна из групп элементов с похожими валентными оболочками.
|
Элемент |
Заряд ядра, Z |
Валентная оболочка |
|
H |
1 |
...1s1 |
|
Li |
3 |
...2s1 |
|
Na |
11 |
...3s1 |
|
K |
19 |
...4s1 |
|
Rb |
37 |
...5s1 |
|
Cs |
55 |
...6s1 |
|
Fr |
87 |
...7s1 |
Все эти элементы должны иметь сходные химические и физические свойства. Во–первых, они должны быть одновалентны, потому что могут отдавать с внешнего уровня только один электрон для образования одной пары электронов, поделенной с атомом какого–нибудь другого элемента.
Во–вторых, все перечисленные элементы должны охотно отдавать свой единственный внешний электрон в химических реакциях с другими атомами. Действительно, для них это самый быстрый путь приобретения завершенной электронной оболочки, подобной внешней оболочке одного из инертных газов. Например, металл натрий должен легко превращаться в ионы натрия Na+:
Na (1s12s22p63s1) – 1e– = Na+ (1s12s22p6 – оболочка инертного газа неона Ne)
Иными словами, все перечисленные в таблице 4-1 элементы должны быть хорошими восстановителями, легко отдающими свои электроны окислителям. В своих соединениях с другими элементами они, как уже отмечалось выше, должны быть одновалентны, а в ионных соединениях существовать в виде однозарядных положительных ионов. Чаще всего их степень окисления должна быть равна +1. Покажем это на примерах изменения степеней окисления в окислительно–восстановительных реакциях с участием Na и K:

В–третьих, сами эти элементы должны быть металлами, потому что их атомы могут связываться между собой только металлической связью. Как вы помните, малое число валентных электронов не дает возможности атомам элемента связаться между собой октетными, завершенными молекулярными электронными оболочками, поэтому они образуют ионную кристаллическую решетку, которую омывает "электронный газ" (именно такой вид химической связи называется металлической связью).
Исключение должен составлять ВОДОРОД – ему до завершенной электронной оболочки 1s2 не хватает всего 1–го электрона, поэтому атом водорода образует с другим атомом водорода не металлическую, а обыкновенную ковалентную связь H:H.
Таким образом, несмотря на некоторые различия в свойствах, все элементы из табл. 4–1 можно считать определенной группой схожих между собой элементов.
Но в этом случае зададимся вопросом: если Li (Z=3) и Na (Z=11) являются однотипными элементами, то что происходит "на пути" от Li к Na, то есть при возрастании заряда ядра от 3 до 11? Какие свойства имеют элементы с Z = 4, 5, 6, ... 10?
Оказывается, свойства этих элементов меняются постепенно – по мере заполнения внешних электронных оболочек все возрастающим числом электронов. Но только до определенного предела! Элемент с зарядом ядра Z=10 (инертный газ неон) уже очень сильно отличается по своим свойствам от элемента Li, но буквально следующий за неоном элемент Na (Z=11) является химическим аналогом лития!
Это явление легко объяснимо с точки зрения электронного строения атомов. Действительно, если электронные уровни заполняются от элемента к элементу постепенно, то рано или поздно электронные конфигурации внешних электронных оболочек должны повторяться. А раз так, то должны повторяться и химические особенности в поведении элементов.
Поясним это рисунком 4-1 на примере элементов от Z=3 (Li) до Z=11 (Na) и далее до элемента с Z=19 (K):
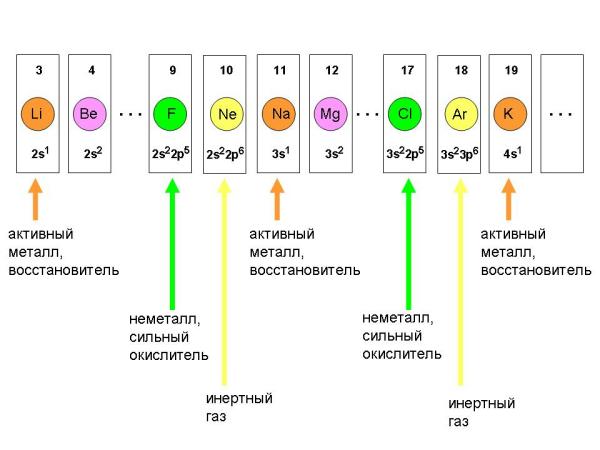
Рис. 4-1. При расположении в ряд элементов с зарядом ядра от Z=3 до Z=19 наблюдается определенная периодическая закономерность в изменении химических свойств элементов.
Таким образом, в изменении свойств элементов наблюдается определенная периодичность, которая выражается в том, что по мере заполнения электронных оболочек свойства элементов периодически повторяются.
 Разумеется, речь не идет об абсолютно точном повторении. Например, у калия валентный электрон находится гораздо дальше от ядра, чем у натрия и у лития. Поэтому калий – более активный восстановитель. Он легче отдает свой внешний электрон другим элементам по сравнению с натрием и литием. Это можно наблюдать и в опыте: калий более бурно реагирует с водой. Таковы различия у однотипных элементов: Li, Na, K.
Разумеется, речь не идет об абсолютно точном повторении. Например, у калия валентный электрон находится гораздо дальше от ядра, чем у натрия и у лития. Поэтому калий – более активный восстановитель. Он легче отдает свой внешний электрон другим элементам по сравнению с натрием и литием. Это можно наблюдать и в опыте: калий более бурно реагирует с водой. Таковы различия у однотипных элементов: Li, Na, K.
Итак, в ряду от лития до калия (рис. 4-1) свойства элементов монотонно изменяются и периодически повторяются. Натрий и калий повторяют свойства лития, магний в чем–то повторяет свойства бериллия, хлор повторяет свойства фтора, а аргон – неона.
Но, например, магний, хлор и аргон сильно отличаются друг от друга по химическим свойствам. Итак, переходя от элемента к элементу на рис. 4–1 мы наблюдаем, что их свойства меняются постепенно от свойств активного металла до свойств инертного газа, но неизбежно периодически повторяются.
Свойства элементов периодически изменяются в соответствии с зарядом ядер их атомов.
Мы только что сформулировали Периодический закон в его современной трактовке. Этот фундаментальный закон природы был открыт великим русским химиком Д.И. Менделеевым в 1869 году – задолго до изучения строения атома. С первоначальной формулировкой Периодического закона мы познакомимся после того, как рассмотрим Периодическую таблицу элементов.
_________________