HCl
H2SO4
§10.3. Водородный показатель. Шкала рН.
Для начала полезно дать определение кислотам и основаниям с точки зрения теории электролитической диссоциации. В водных растворах кислот всегда присутствуют ионы Н+, а растворах оснований (щелочей) присутствуют ионы ОН–. Таким образом:
Кислота - это электролит, при диссоциации которого образуются катионы водорода и анионы кислотного остатка.
Например:
HCl ![]() H+ + Cl– (соляная кислота),
H+ + Cl– (соляная кислота),
H2SO4 ![]() 2H+ + SO42– (серная кислота).
2H+ + SO42– (серная кислота).
Основание - это электролит, диссоциирующий на катионы металла и гидроксид-анионы.
Например:
NaOH ![]() Na+ + OH– (едкий натр),
Na+ + OH– (едкий натр),
Ba(OH)2 ![]() Ba2+ + 2OH–.(гидроксид бария).
Ba2+ + 2OH–.(гидроксид бария).
Водные растворы веществ могут быть нейтральными, кислыми или щелочными. В кислых растворах содержится избыток ионов Н+, а в щелочных – избыток ионов ОН–. В нейтральных растворах количество этих ионов всегда одинаково и при этом чрезвычайно мало – по 10–7 моль/л каждого иона (о том, как это выяснилось, чуть позже). Низкая концентрация ионов Н+ и ОН– в нейтральном растворе вполне объяснима – ведь эти ионы охотно реагируют друг с другом, поскольку в результате образуется прочное, малодиссоциированное соединение Н2О. Таким образом, в нейтральном растворе присутствуют только те ионы Н+ и ОН–, которые образовались из самой воды естественным путем, в результате ее обратимой диссоциации:

Впрочем, даже для такого слабого электролита, как вода, можно измерить константу диссоциации Кд:

Эта константа настолько мала, что содержанием свободных ионов в чистой воде, казалось бы, можно спокойно пренебречь! Однако в химии растворов эта величина пригодилась для создания шкалы рН (читается «пэ-аш»), с помощью которой количественно выражают кислотность или щелочность растворов с гораздо более высоким содержанием ионов Н+ или ОН–.
Чтобы разобраться в том, как устроена шкала рН, сначала упростим выражение для константы диссоциации воды. Действительно, величина [Н2О] есть не что иное, как молярная концентрация воды, выраженная в моль/л. Но число молей воды в 1 л воды всегда постоянно! Если рассматривать чистую воду как «раствор воды в воде», то нетрудно посчитать число молей Н2О в 1 л воды.
Масса 1 моля воды 18 г (молярная масса воды), а масса 1 литра воды составляет 1000 г (примем, что плотность Н2О при комнатной температуре не сильно отличается от 1 г/см3):
18 г Н2О – 1 моль,
1000 г Н2О (1 л) – х моль.
Отсюда:

Следовательно, в 1 л чистой воды всегда содержится 55,6 моль Н2О, а значение [Н2О] = 55,6 моль/л является величиной постоянной.

Теперь мы можем умножить константу диссоциации воды на эту постоянную величину 55,6. Получим:
55,6·Кд = [Н+][ОН–] = 55,6·1,8·10–16 = 100·10–16 = 10–14
Если новую константу 55,6·Кд обозначить как Кw (от английского water – вода), получается выражение, называемое ионным произведением воды:
Кw = [Н+][ОН–] = 10–14
Концентрация ионов Н+ и ОН– в чистой воде при комнатной температуре всегда одинакова и имеет следующие значения:
[Н+] = 10–7,
[ОН–] = 10–7 моль/л.
Действительно, только в этом случае получается нужное произведение [10–7][10–7] = 10–14.
Константа Кw (как и константа диссоциации Кд) выводится из константы равновесия Кр и обладает всеми ее полезными свойствами. В частности, ионное произведение воды при комнатной температуре всегда сохраняет постоянное значение, причем независимо от изменения концентраций [Н+] и [ОН–]. Например, если добавить в воду кислоту (то есть внести посторонние ионы Н+), то в растворе понизится концентрация ионов [ОН–], но Кw сохранит значение 10–14. В случае добавления щелочи (т.е. посторонних ионов ОН–) понизится концентрация ионов [Н+], но значение Кw тоже не изменится.
Для воды и ее растворов при неизменной температуре произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная. Эта постоянная величина называется ионным произведением воды Кw.
Замечательное свойство ионного произведения воды всегда оставаться постоянным лежит в основе шкалы рН (рис. 10-2). Вместо термина «рН раствора» часто используют термин «водородный показатель». Это название подчеркивает, что кислотность или щелочность растворов можно выразить через концентрацию одних только ионов водорода Н+. Дадим первоначальное определение величины рН:
Если концентрацию ионов водорода в растворе выразить как [Н+]= 10–n моль/л, то рН = n.

Рис. 10-2. Шкала рН. Ниже шкалы показаны цвета универсальной индикаторной бумаги. Цвет бумажной полоски изменяется в зависимости от рН раствора, которым она смочена.
Итак, рН равен показателю степени n, взятому с обратным знаком. Например, концентрация ионов водорода в нейтральном растворе составляет [Н+] = 10–7 моль/л (n = –7). Следовательно, в нейтральном растворе рН = 7.
Для нейтральных растворов и чистой воды рН = 7.
Это значение (рН = 7) располагается точно посередине шкалы. Теперь надо разобраться в том, как получаются крайние значения шкалы слева и справа: 0 и 14.
Допустим, имеется раствор сильной одноосновной кислоты (например, HCl или HBr) концентрации 1 моль/л. В этом случае концентрация ионов водорода Н+ тоже составит 1 моль/л. Ионное произведение воды и в таком растворе сохраняет свое значение:
Кw = [1 моль/л][ОН–] = [1 моль/л][10–14] = 10–14.
В таком случае [Н+] = 100 (поскольку 100 = 1 моль/л). Следовательно, рН = 0. Это самый кислый раствор в шкале рН.
Рассмотрим другую крайнюю ситуацию - раствор сильного основания NaOH концентрации 1 моль/л. Ионное произведение воды принимает вид:
Кw = [Н+][1 моль/л] = 10–14.
Здесь [Н+] = 10–14. Следовательно, рН = 14. Итак, мы получили крайние точки шкалы для самого кислого и самого щелочного раствора, которые рассматриваются в данной шкале.
Чем меньше рН, тем выше кислотность среды. И наоборот, чем больше рН, тем выше щелочность среды.
Приведем конкретные примеры. Допустим, имеется раствор сильной кислоты HCl концентрации 0,01 моль/л. Поскольку молекулы HCl в растворе полностью распадаются на ионы, концентрация ионов Н+ тоже составит 0,01 моль/л (или 10–2 моль/л), а рН = 2. Мы видим, что для кислых растворов рН < 7).
В щелочных растворах, напротив, рН > 7. Покажем это на примере раствора сильного основания NaOH, концентрация которого тоже 0,01 моль/л. Концентрация ионов ОН– составит 0,01 моль/л (или 10–2). Поскольку Кw всегда остается постоянной, можно вычислить концентрацию ионов водорода и рН в таком растворе:
Кw = [Н+][10–2] = 10–14
или

Следовательно, в данном случае рН = 12.
В общем случае формула, помогающая определить рН щелочных растворов, выглядит так:

Раньше, в §8.5 мы уже рассказывали о специальных веществах – индикаторах – с помощью которых можно качественно определять среду раствора. Индикаторы меняют цвет в зависимости от кислотности или щелочности растворов. Достаточно добавить 1-2 капли разбавленного водно-спиртового раствора индикатора в исследуемый раствор, чтобы проявилась окраска. Например, индикатор фенолфталеин в щелочных растворах малиновый, а в кислых растворах – бесцветный. Индикатор лакмус дает красное окрашивание в кислой среде, а в щелочной – синее. Здеь мы воспроизводим таблицу индикаторов из §8.5, но теперь уже с указанием интервалов рН, в которых происходят цветовые переходы.
Таблица 10-2. Цветовые переходы некоторых индикаторов в зависимости от рН среды.
|
Цвет индикатора, интервал рН: |
|||
|
Индикатор |
в кислой среде |
в нейтральной |
в щелочной |
|
Лакмус
|
красный бесцветный красный |
фиолетовый бледно-розовый оранжевый |
синий малиновый желтый |

 Посмотрите еще раз видеоопыты, в которых показывается действие кислот и щелочей на разные индикаторы.
Посмотрите еще раз видеоопыты, в которых показывается действие кислот и щелочей на разные индикаторы.
Как видно из таблицы 10-2, рН раствора не обязательно может иметь целочисленное значение. В отличие от индикаторной бумаги, современные электронные приборы – рН-метры – измеряют рН с точностью до двух знаков после запятой.
** Более строго водородный показатель определяется следующим образом: рН раствора равен обратному логарифму от концентрации ионов водорода в этом растворе.
pH = – lg [H+]
Не все наши читатели уже знакомы с логарифмами, поэтому коротко объясним, что это такое. Десятичный логарифм числа а, т.е. логарифм по основанию 10 (обозначение log10а или lgа), показывает, в какую степень надо возвести число 10 (основание логарифма), чтобы получить число а.
Например,
lg100 = 2 (поскольку 102 = 100),
lg1000 = 3,
lg10 = 1,
lg1 = 0 (поскольку 100 = 1), и т.д.
Логарифмы обладают многими полезными свойствами, необходимыми для сложных вычислений. Среди них два важных соотношения:
lgab = lga + lgb,
lgab = blga.
Например, для нейтральных растворов, где [H+] = 10–7, получим:
pH = – lg10–7 = – (– 7 lg10) = 7.
Концентрация ионов водорода не обязательно выражается только как 10n. Например, имеется раствор с концентрацией ионов водорода [H+] = 5,1·10–3. Каков рН такого раствора? Используем одно из свойств логарифмов:
рН = – lg 5,1·10–3 = – (lg 5,1 + lg10–3).
Для второго члена этой суммы можно применить другое свойство логарифмов:
рН = – (lg 5,1 + lg10–3) = – (lg 5,1 – 3 lg10), или
рН = 3 – lg 5,1.
С помощью инженерного калькулятора можно вычислить значение lg 5,1 = 0,7. Отсюда рН = (3 – 0,7) = 2,7.
Область применения водородного показателя очень широка: это не только аналитическая химия, но и пищевая промышленность, экология, биология, медицина. Например, рН свежего молока должен быть в интервале 6,6–6,9. Речная и водопроводная вода имеют рН немного меньше 7. В морской воде среда слабощелочная (рН = 8). Кровь человека должна сохранять значение рН в очень узком интервале: 7,35–7,45. Изменение на 0,1–0,2 единицы рН может иметь тяжелые последствия для здоровья. Косметические и моющие средства проходят проверку на оптимальное значение рН для того, чтобы при их использовании не страдала кожа.
** Но как вычисляют рН в растворах слабых кислот и оснований? Ведь в этом случае распад на ионы происходит не полностью. Например, в растворе слабой кислоты концентрация ионов H+ уже не будет равна концентрации самой кислоты. Здесь на помощь приходит закон разбавления Оствальда для слабых электролитов (см. предыдущий параграф). Константа диссоциации Кд и степень диссоциации α слабых электролитов связаны соотношением:
Кд = α2С
(где С - концентрация слабого электролита в моль/л). Отсюда:
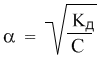
В этом выражении можно умножить левую и правую части на концентрацию С:

Но дело в том, что αС = [H+] (здесь мы рассматриваем пример слабой кислоты). Поэтому можно записать:

Таким образом, зная концентрацию раствора слабой кислоты и ее константу диссоциации, можно рассчитать концентрацию ионов водорода H+, а затем и рН раствора. Однако следует помнить, что такой способ годится только для определения рН растворов слабых кислот и оснований.
ЗАДАЧИ
10.7. (НГУ). Рассчитайте рН а) 0,05 М раствора серной кислоты, б) 0,1 М раствора гидроксида калия. Как изменится рН этих растворов при разбавлении в 10 раз?
10.8. Имеется раствор соляной кислоты с рН = 5. Какова концентрация ионов водорода в таком растворе? Раствор разбавили в 10 раз – каким станет его рН? Раствор разбавили еще в 10 раз – каков теперь рН раствора? Если полученный раствор разбавить еще в 10 раз, сможет ли он стать щелочным?
10.9. (НГУ). В 200 мл раствора NaOH содержится 1,204·1021 ионов натрия. Рассчитайте рН раствора. Как изменится значение рН при добавлении к этому раствору 100 мл 0,05 М раствора HCl?
10.10. (НГУ). Между собой реагируют 2,0 г водорода и 2,0 г хлора. Образовавшийся газ поглощается в 560 мл H2O (без изменения объема раствора). Определите рН полученного раствора.
** 10.11. Рассчитайте рН 0,01 М водного раствора бензойной кислоты С6Н5СООН (Кд = 6,60·10-5).
** 10.12. (НГУ). Рассчитайте рН раствора, полученного при количественном взаимодействии 100 мл 0,01 М водного раствора сероводорода с газообразным хлором, который при Р = 1 атм и tо = 25 оС занимает объем 97,8 мл. Указание: объем раствора не меняется, образующиеся кислоты диссоциируют полностью.
_________________