
§3.4. Электроотрицательность. Различие между полярной ковалентной и ионной связями.
Только о небольшой части всех химических связей можно сказать, что они являются чисто ковалентными. В таких соединениях поделенная пара электронов всегда находится на одинаковом расстоянии от ядер обоих атомов. Это возможно тогда, когда между собой связаны одинаковые атомы. Например, из рассмотренных нами в этой главе молекул чисто ковалентными окажутся двухатомные молекулы водорода, кислорода, хлора, азота:

Когда между собой связываются разные атомы, поделенная пара химической связи всегда смещена к одному из атомов. К какому? Разумеется, к тому атому, который проявляет более сильные акцепторные свойства.
Допустим, при образовании двухатомной молекулы АБ электроны связи смещаются в сторону атома Б. В этом случае атом Б считается более электроотрицательным, чем атом А. С помощью формул Льюиса можно изобразить смещение пары электронов следующим образом:

Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Молекулы многих соединений состоят из атомов разного вида и поэтому содержат полярные ковалентные связи. Например, полярные ковалентные связи присутствуют в соединениях:
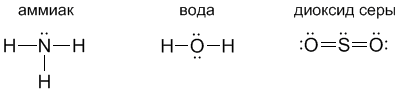
Для примера рассмотрим диоксид серы SO2. Кислород и сера имеют похожие валентные оболочки (...2s2 2p4) и (...3s2 3p4), но внешние электроны серы находятся дальше от ядра и притягиваются к ядру слабее, чем у кислорода. Из-за этого поделенные электронные пары в молекуле SO2 смещены вдоль химических связей в сторону атомов кислорода, которые приобретают частичный отрицательный заряд. Такой частичный заряд обозначают греческой буквой "дельта". Атом серы приобретает частичный положительный заряд, а атомы кислорода – частичный отрицательный заряд.

Электроотрицательность зависит не только от расстояния между ядром и валентными электронами, но и от того, насколько валентная оболочка близка к завершенной. Атом с 7 электронами на внешней оболочке будет проявлять гораздо большую электроотрицательность, чем атом с 1 электроном.
Фтор является "чемпионом" электроотрицательности по двум причинам. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего одного электрона) и, во-вторых, эта валентная оболочка (...2s2 2p5) расположена близко к ядру. Например, в соединении NaF поделенная электронная пара оттянута к атому фтора так сильно, что можно, почти не погрешив против истины, приписать фтору целый отрицательный, а натрию – целый положительный заряд:
Na+F–
Если вспомнить раздел 3.2, то такую связь уже лучше назвать ионной. Впрочем, запись формулы в ионном виде является условной. Она лишь означает, что поляризация ковалентной связи велика. Запись структуры с помощью формулы Na–F тоже правильна, потому что поляризация связи может быть близка к 100%, но никогда не достигает этой величины. Например, в NaF поляризация связи составляет около 80%. Таким образом:
Ионную связь можно рассматривать как предельный случай полярной ковалентной связи.
Внешне соединения с ионными и ковалентными связями могут довольно сильно отличаться друг от друга. Ионные соединения – обычно твердые и хрупкие вещества, плавящиеся при высоких температурах. Растворы ионных соединений проводят электрический ток, потому что при растворении они распадаются на заряженные ионы. Типичное ионное соединение – поваренная соль NaCl.
Соединения с ковалентными и полярными ковалентными связями в обычных условиях часто являются газами или жидкостями. Если это твердые вещества, то плавятся они достаточно легко, хотя есть и исключения, которые мы обсудим в §3.8. Растворы таких веществ далеко не всегда проводят электрический ток, потому что при растворении они могут и не распадаться на ионы. Типичные соединения с полярными ковалентными связями: хлороводород HCl, углекислый газ СО2, вода Н2О, песок SiO2, многочисленные органические соединения.
На примере родственных соединений HCl и NaCl можно видеть, как увеличение полярности связи может в итоге приводить к качественным изменениям в свойствах веществ при одинаковых условиях (рис. 3-4).

Рис. 3-4. Хлороводород HCl (содержит полярную ковалентную связь) при комнатной температуре – газообразное вещество. В этих же условиях поваренная соль NaCl (ионная связь между атомами) – твердое кристаллическое вещество.
Иногда встречается утверждение, что ионная связь – это химическая связь, возникающая в результате кулоновского притяжения противоположно заряженных ионов. Действительно, электростатическое притяжение противоположных зарядов в ионных соединениях вносит заметный вклад в энергию связи. Но в то же время ковалентная составляющая химической связи никогда не выключается полностью даже в наиболее ионных соединениях.
Таким образом, граница между полярными ковалентными и ионными соединениями достаточно условна. Например, чистая вода (полярное ковалентное соединение) все-таки обладает электропроводностью (правда, очень низкой), а если поваренную соль (ионное соединение) расплавить и нагреть до кипения в вакууме, то в парах будут присутствовать молекулы Na–Cl, а не отдельные ионы Na+ и Cl–.
Можно ли измерить степень полярности ковалентной связи? Где кончается полярная ковалентная связь и начинается ионная?
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом. Электроотрицательность (X) измеряется в относительных величинах (таблица 3-3).
Таблица 3-3. Электроотрицательности (X) некоторых элементов.
Данные из справочника: CRS Handbook of Chemistry and Physics (издание 2007 года).

Электроотрицательнось по Полингу – это свойство атомов, связанных химическими связями, т.е. находящихся в составе химических соединений. Соединения таких благородных элементов, как гелий, неон и аргон до сих пор не получены, поэтому не определена и ЭО этих элементов. Однако в полной таблице в приложении VII уже можно найти значения для ксенона (Xe), соединения которого с фтором и кислородом известны с 60-х годов ХХ века.
Для фтора во многих книгах приводится значение X = 4,0 и в этом нет ошибки. Просто в таблице 3-3 приведены уточненные данные и, кроме того, значение 3,98 вполне может быть округлено до 4,0.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов Li, Na, Mg и т.д. И это понятно – ведь их внешние электронные оболочки далеки от завершения и для них выгоднее сдвинуть свои валентные электроны к чужому атому, чем "добирать" электроны у соседей.
Обратите внимание на необычно высокую электроотрицательность атома водорода (X = 2,20) – она значительно выше значений для щелочных металлов. В этом нет ничего удивительного: атом водорода лишь формально является электронным аналогом атомов щелочных металлов – на самом деле ему не хватает только одного электрона для полного завершения своей валентной оболочки (как и атомам галогенов с их высокими значениями X). Поэтому электроноакцепторные свойства атома водорода выражены сильнее, чем у щелочных металлов.
Допустим, между двумя какими-то элементами образовалась химическая связь. Теперь разность электроотрицательностей этих элементов (ΔX) позволит нам судить о том, насколько эта связь отличается от чисто ковалентной.
Какие бы два атома не были связаны между собой, для вычисления ΔX нужно из большей электроотрицательности вычесть меньшую.
Для чисто ковалентной связи такая разница всегда равна нулю, например:
а) связь F—F в молекуле фтора F2: ΔX = (3,98 - 3,98) = 0 (ковалентная связь);
б) связь O=O в молекуле кислорода O2: Δ
X = (3,44 - 3,44) = 0 (ковалентная связь).
Если величина Δ X меньше, чем 0,4 – такую связь тоже условно называют ковалентной.
При разности электроотрицательностей от 0,4 до 2,0 связь называют полярной ковалентной, например:
в) связь H—F в молекуле фтороводорода HF: Δ
X = (3,98 - 2,20) = 1,78 (полярная ковалентная связь);
г) связь C—Cl в молекуле CСl4: Δ
X = (3,16 - 2,55) = 0,61 (полярная ковалентная связь);
д) связь S=O в молекуле SO2: Δ
X = (3,44 - 2,58) = 0,86 (полярная ковалентная связь).
Чем больше разность электроотрицательностей, тем больше доля ионности связи. Условно принято, что связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например:
е) связь Na—Cl в соединении NaCl: Δ
X = (3,16 - 0,93) = 2,23 (ионная связь);
ж) связь Na—F в соединении NaF: Δ
X = (3,98 - 0,93) = 3,05 (ионная связь);
з) связь K—O в соединении K2O: Δ
X = (3,44 - 0,82) = 2,62 (ионная связь).
Таким образом, при возникновении химической связи происходит не только обобществление электронов, но и в ряде случаев передача электронов от одного атома другому. Эта передача может быть частичной или почти полной. Электроны всегда передаются от атома с меньшей электроотрицательностью атому с большей электроотрицательностью.
Задачи.
3.14. Определите характер связи в приведенных ниже соединениях и разделите их на три группы: а) соединения с ковалентными связями, б) с полярными ковалентными связями, в) с ионными связями. Решение обоснуйте.
PH3, CaO, Br2, BeCl2, CsBr, S8 (циклическая молекула), BF3, H2, Li2O.
3.15. В таблице 3-3 в тексте параграфа не приведены электроотрицательности для благородных газов. Попробуйте предсказать значение электроотрицательности ксенона в соединении XeF6 (речь идет о качественной оценке: “больше чем у фтора”, “меньше чем у фтора”). Проверьте свое предположение по таблице электроотрицательностей элементов в приложении. Предложите свое объяснение экспериментальным фактам.
_________________