Группы элементов |
| Пери- оды |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
| 1 | 1 водород H 1,0079 |
2 гелий He 4,0026 |
||||||
| 2 | 3 литий Li 6,941 |
4 бериллий Be 9,01218 |
5 бор B 10,81 |
6 углерод C 12,011 |
7 азот N 14,0067 |
8 кислород O 15,9994 |
9 фтор F 18,9984 |
10 неон Ne 20,179 |
| 3 | 11 натрий Na 22,98977 |
12 магний Mg 24,305 |
13 алюминий Al 26,98154 |
14 кремний Si 28,0855 |
15 фосфор P 30,97376 |
16 сера S 32,06 |
17 хлор Cl 35,453 |
18 аргон Ar 39,948 |
4 |
19 калий K 39,0983 |
20 кальций Ca 40,08 |
и так далее |
Рис.4-2.Часть Периодической таблицы Д. И. Менделеева, построенная на основании данных таблицы 4-2.
Горизонтальные строчки Периодической таблицы называются ПЕРИОДАМИ, а вертикальные - ГРУППАМИ.
В группах собраны элементы с похожими химическими свойствами, а в периодах химические свойства постепенно изменяются.
Если сравнить между собой элементы разных периодов, то можно отметить важную особенность:
Номер ПЕРИОДА, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
В этом заключается физический и химический смысл номера периода. Как же изменяются свойства элементов одного периода?
В левой части периодов элементы проявляют ярко выраженные восстановительные свойства. Большинство из этих элементов являются металлами (Li, Na, Mg, Ca).
В правой части собраны типичные неметаллы, обладающие окислительными свойствами (O, F, Cl).
В середине периодов располагаются элементы, обладающие как восстановительными, так и окислительными свойствами. Эти окислительные или восстановительные свойства зависят от того, с каким элементом они реагируют.
Например, если сера (S) реагирует с сильным окислителем (кислородом), то проявляет восстановительные свойства:

А при взаимодействии с сильным восстановителем (например, с железом) сера играет роль окислителя:
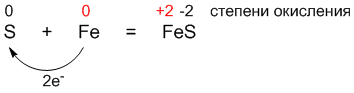
Периоды объединяют в себе несхожие по своим свойствам элементы. Тем не менее, все периоды подчиняются важной общей закономерности:
Каждый период Периодической таблицы начинается активным металлом и заканчивается инертным газом.
О том, какой электронный признак объединяет элементы в группы, мы уже знаем: элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек.
Номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей.
Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов. В этом заключается физический смысл номера группы.
** Некоторые группы Периодической таблицы имеют традиционные названия (таблица 4-3). Элементы 1-й группы (за исключением водорода) называются ЩЕЛОЧНЫМИ металлами, элементы 2-й группы - ЩЕЛОЧНОЗЕМЕЛЬНЫМИ металлами, элементы 6-й и 7-й групп - ХАЛЬКОГЕНАМИ и ГАЛОГЕНАМИ. О происхождении таких традиционных названий мы уже либо рассказывали (например, о БЛАГОРОДНЫХ ГАЗАХ), либо еще расскажем в главах, которые специально посвящены этим элементам.
Таблица 4-3. Групповые названия элементов.
|
Груп-па |
Название |
Элементы |
Внешняя оболочка |
|
I |
Щелочные металлы |
Li, Na, K, Rb, Cs, Fr |
s1 |
|
II |
Щелочноземельные металлы |
Be, Mg, Ca, Sr, Ba, Ra |
s2 |
|
III |
Нет группового названия |
s2p1 |
|
|
IV |
Нет группового названия |
s2p2 |
|
|
V |
Нет группового названия |
s2p3 |
|
|
VI |
Халькогены |
O, S, Se, Te, Po |
s2p4 |
|
VII |
Галогены |
F, Cl, Br, I, At |
s2p5 |
|
VIII |
Благородные газы |
Ne, Ar, Kr, Xe, Rn |
s2p6 |
Следует рассказать о несколько особом положении водорода в Периодической таблице. Водород имеет электронную конфигурацию 1s
1. Этому элементу в Периодической таблице в равной степени подходит место и в 1-й группе (где щелочные металлы могут легко отдавать свой единственный s-электрон), так и в 7-й группе (где элементам достаточно принять 1 электрон для завершения внешней оболочки). Поэтому водород формально можно поместить в любую из этих групп. Оба варианта будут правильными.Каждая клеточка Периодической таблицы несет определенную информацию об элементе, которую надо уметь читать.
Во многих изданиях Периодической таблицы s-, p-, d- и f-элементы выделяют разными цветами. Клеточки элементов, у которых заполняются s-орбитали, обычно окрашивают в красный цвет. Клеточки с элементами, у которых в процессе заполнения находятся p-орбитали - в желтый цвет. Таким образом, в красных клеточках находятся s-элементы, а в желтых - p-элементы.
Голубым цветом обозначены клеточки с d-элементами и зеленым - с f-элементами. Цвета носят вспомогательный характер и в разных изданиях таблицы могут быть разными. Но вы должны одинаково хорошо ориентироваться и в черно-белой таблице.

Рис. 4-3. Информация об элементе, содержащаяся в отдельной клеточке Периодической таблицы (см. также текст).
Рассмотрим какую-нибудь отдельную клеточку Периодической таблицы, изданной не обязательно в нашем учебнике (рис. 4-3). Здесь мы найдем прежде всего латинский символ и русское название элемента. В нижней части клеточки приводится такая важная характеристика элемента, как его относительная атомная масса (атомный вес). В верхней части клеточки мы видим число, обозначающее заряд ядра Z.
Заряд ядра Z совпадает с ПОРЯДКОВЫМ НОМЕРОМ элемента в Периодической таблице.
Многие из вас наверняка заметили, что среди порядковых номеров элементов в Периодической таблице нет перерывов. Это означает, что все грядущие открытия новых элементов возможны только для элементов с порядковым номером больше 118, а все клеточки Периодической таблицы с порядковыми номерами от 1 до 118 уже заполнены и здесь не следует ожидать открытий каких-нибудь новых элементов. До появления Периодической таблицы это вполне ясное нам с вами обстоятельство совсем не было очевидным, и поиски многих новых элементов велись химиками практически вслепую.
** Совпадение зарядов ядер Z с порядковыми номерами элементов является чрезвычайно важным фактом. Периодическая таблица была составлена Д.И. Менделеевым в 1869 году, а заряды ядер атомов элементов научились определять только в 1914 году.
Совпадение говорит прежде всего о том, что перед нами не просто один из способов систематизации элементов (таких было немало в истории химии), а фундаментальный закон природы, записанный Д. И. Менделеевым в виде Периодической таблицы.
Продолжим рассмотрение отдельной клеточки Периодической таблицы (рис. 4-3). Во многих ее изданиях справа за рамкой таблицы отмечены уже заполненные или еще заполняемые электронные уровни. Уровни 1, 2, 3, ... также часто обозначают буквами K, L, M (и так далее по латинскому алфавиту). Нам нужно иметь в виду, что главные уровни в разных изданиях таблицы могут обозначаться не только цифрами, но и буквами.
В правой части каждой клеточки иногда пишут число электронов, которое имеется у данного элемента на каждом уровне.
Например, у элемента магния (Mg) имеется 2 электрона на первом уровне К, 8 электронов на втором уровне L и еще 2 электрона на третьем уровне М. В сумме это составляет 12 электронов.
Магний является s-элементом (поэтому клеточку с
Mg обычно окрашивают в красный цвет), имеет порядковый (атомный) номер 12 и такой же заряд ядра Z. Его атомный вес составляет 24,305 а.е.м. (атомных единиц массы).Магний –
s-элемент, находящийся во II группе, поэтому он должен быть металлом (ведь всем металлам далеко до завершения внешнего электронного уровня!). Его валентность в соединениях с другими элементами должна быть равной номеру группы, то есть II. Например, формула соединения магния с кислородом (оксида магния) должна быть такой: MgO.По своим химическим свойствам ближайшими аналогами магния являются его соседи по II группе Периодической таблицы - бериллий (Be) и кальций (Ca). Оба они двухвалентны, а формулы их оксидов соответственно BeO и CaO.
Это лишь часть полезной информации об элементе, которую можно получить, заглянув в Периодическую таблицу.
Задачи.
4.1. Напишите электронные формулы внешних оболочек следующих элементов: 14Si, 15P, 16S, 17Cl, 34Se, 52Te. Три элемента из этого ряда являются химическими аналогами (проявляют похожие химические свойства). Какие это элементы?
4.2. Между собой реагируют элементы: а) сурьма и азот; б) алюминий и хлор. Не записывая уравнений реакций, укажите в каждой из этих пар окислитель и восстановитель, пользуясь только Периодической таблицей.
4.3. Каждый из перечисленных ниже элементов способен образовывать ионы в химических реакциях. С помощью Периодической таблицы предскажите заряды наиболее распространенных ионов лития (Li), стронция (Sr), алюминия (Al), титана (Ti), астата (At). Ответ обоснуйте.
**
4.4. Сравните электронную конфигурацию атомов азота и фосфора. Какую валентность и степени окисления они могут проявлять в химических соединениях? Приведите формулы соединений этих элементов с водородом. Приведите формулы их соединений с кислородом в высшей степени окисления._________________
Хотите поработать на 2-м уровне? Тогда переходите к **§4.3. Если осваиваете пока только 1-й уровень, пропустите параграфы **§4.3, **§4.4 и перейдите к §4.5.
_________________