
§5.5 Молярный объем газов. Закон Авогадро. Постоянная Авогадро.
Значение 6,02·1023 называется ПОСТОЯННОЙ АВОГАДРО в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества. Она имеет обозначение NA. Иногда ее также называют ЧИСЛОМ АВОГАДРО.
Постоянная Авогадро NA = 6,02·1023
Как мы уже говорили, именно такое количество молекул содержит 1 моль кислорода О
2, такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H2O и т.д. Но для газообразных веществ понятие моль имеет еще одну важную особенность: такое количество частиц любого газа всегда занимает одинаковый объем. Вот как это выяснилось.Французский химик и физик Гей-Люссак в 1808 году изучал удивительную (по тем временам) химическую реакцию, в которой из двух газов – хлористого водорода и аммиака - получалось твердое кристаллическое вещество - хлорид аммония:
HCl (газ)
+ NH3 (газ) = NH4Cl (крист.)Обнаружилось, что для реакции требуются равные объемы обоих газов – HCl и NH3. Если один из этих газов вначале имелся в избытке, то по окончании реакции этот избыток оставался неиспользованным.

Рис. 5-3. "Дым без огня". Соляную кислоту приливают в колбу, наполненную раствором аммиака. Газообразные HCl и NH3 выделяются из растворов и тут же реагируют между собой с образованием белого "дыма" - мелких кристаллов NH4Cl (кадр из видеоопыта "Единой коллекции цифровых образовательных ресурсов"; постановка опыта - к.п.н. П. Беспалов).
В отличие опыта на рис. 5-3, Гей-Люссак проводил свои опыты в замкнутом сосуде – достаточно прочном для того, чтобы выдержать реакции, идущие со взрывом. Поэтому он смог изучить и некоторые другие реакции между газами. Выяснилось, что два объема водорода со взрывом реагируют с одним объемом кислорода, образуя 2 объема газообразных водяных паров:
2 H2 + O2 = 2 H2O (все вещества – газообразные)
Далее: один объем водорода реагирует с одним объемом хлора, давая 2 объема газообразного хлористого водорода:
H2 + Cl2 = 2 HCl (все вещества – газообразные)
В этих и других экспериментах неизменно обнаруживалось, что газы реагируют между собой (и образуются тоже) в простых целочисленных объемных отношениях.
Гей-Люссак опубликовал свои наблюдения, не делая из них никаких выводов. Важные выводы спустя три года сделал итальянский химик Амедео Авогадро. Он предположил, что РАВНЫЕ ОБЪЕМЫ любых газов содержат РАВНОЕ ЧИСЛО МОЛЕКУЛ.
Действительно, молекулы газов не связаны между собой крепкими связями, как молекулы или атомы твердых веществ. Объем, который они занимают, при прочих равных условиях (температуре и давлении) зависит только от числа молекул газа, но не от конкретного вида этих молекул, поскольку молекулы никак не связаны между собой. Поэтому одинаковые количества молекул разных газов должны занимать одинаковые объемы при данных температуре и давлении.
Как правильно полагал Авогадро, только тогда, когда газы занимали одинаковый объем, N молекул одного газа и N молекул другого газа реагировали между собой без остатка в опытах Гей-Люссака. Впоследствии гипотеза о равном числе молекул в одинаковых объемах газов подтвердилось в многочисленных экспериментах.
Так был сформулирован закон, справедливо названный впоследствии ЗАКОНОМ АВОГАДРО:
Равные объемы любых газов (при одинаковых температуре и давлении) содержат равное число молекул.
** Из закона Авогадро вытекает важное следствие: если в равных объемах всех газов содержится одинаковое число молекул, то молекулярный вес (m) любого газа должен быть пропорционален его плотности: m = k·d (где d – плотность, k - некий коэффициент пропорциональности).
Действительно, плотность (d) газа, как и любого физического тела, измеряется в граммах на литр. Если в литре какого-то газа с "тяжелыми" молекулами, и в литре другого газа
– с "легкими" молекулами – этих молекул одинаковое число, то 1 л первого газа должен весить больше – иными словами, для него значение плотности в г/л будет выше.Чтобы определить коэффициент пропорциональности k, можно воспользоваться измерениями плотности разных газов - например, водорода и кислорода (таблица 5-2).
Таблица
5-2. Плотность газа и его молекулярная масса связаны постоянным коэффициентом k. Плотности газов даны при нормальных условиях: температуре 0° С и давлении 760 мм ртутного столба (273,15 K и 101 325 Па).|
Газ |
Плотность d (г/л) |
Молекулярный вес |
Коэффициент k |
|
H2 |
0,0894 |
2 |
22,37 |
|
O2 |
1,427 |
32 |
22,42 |
|
Среднее значение: 22,4 |
|||
Если молекулярный вес газа мы заменим его молярной массой (М г/моль), то получим уравнение:
М (г/моль) = k·d (г/л).
Здесь размерность коэффициента k должна быть (л/моль). Например, для кислорода:
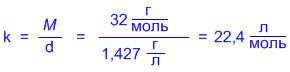
Иными словами, коэффициент k оказывается не просто коэффициентом пропорциональности – он показывает, сколько литров занимает 1 моль любого газа.
1 МОЛЬ любого газа при нормальных условиях (н.у.) занимает объем 22,4 л.
Нормальными условиями (н.у.) считают температуру 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
Итак, 22,4 л – МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ при нормальных условиях. Это очень важная величина, которую следует запомнить. С ее помощью, как мы увидим дальше, можно делать интересные и полезные химические расчеты.
Остается выяснить, как была определена постоянная Авогадро – число молекул газа в 22,4 л газа и в 1 моле любого вещества. Но об этом – в параграфе 5.6.
Задачи.
5.16 Какой объем при нормальных условиях (н.у.) занимают 56 г газообразного азота?
5.17. Какой объем при н.у. занимают 80 г газообразного аргона?
5.18. Чем меньше плотность газа, тем больше подъемная сила у шара, наполненного этим газом. Какова плотность водорода (г/л)? Какова плотность гелия (г/л)? Какой из двух газов выгоднее использовать для заполнения воздушных шаров?
5.19. В кислородной подушке при н.у. находится 6,72 л кислорода. Сколько это граммов кислорода? Сколько это молей кислорода?
5.20. Вычислите плотность газа метана CH4 (г/л) при н.у.
5.21. Некий газ при н.у. имеет плотность 3,17 г/л. Найдите молярную массу и молекулярный вес этого газа? ** Какой это газ? Напишите его формулу и назовите (пользуйтесь Периодической таблицей).
** 5.22. Определите молекулярную массу газообразного соединения азота с кислородом, имеющего плотность 1,34 г (н.у.). Какова молекулярная формула этого соединения?
5.23. Какова плотность газообразного сероводорода H
2S в граммах на литр (при н.у.)?** 5.24. Средний молекулярный вес воздуха (это смесь газов!) составляет 29 а.е.м. Плотность воздуха (1,295 г/л) - больше, чем у водорода или гелия, поэтому наполненные этими газами шары взлетают (“всплывают”) в земной атмосфере. а) Можно ли полететь на воздушном шаре, наполненном неоном? б) Можно ли полететь на воздушном шаре, наполненном сероводородом H
2S? в) Можно ли летать на шаре, наполненном H2S на Венере, где атмосфера состоит из газообразного диоксида углерода CO2? Кстати, сероводород постоянно извергается из венерианских вулканов, поэтому решение задачи в будущем может иметь (или не иметь) практическое значение.** 5.25. (НГУ) Сколько молекул содержится в 60 г фтористого водорода (HF)? В каком объеме газообразного фтора (н.у.) содержится такое же число молекул?
_________________