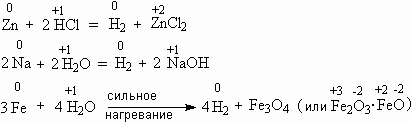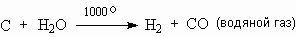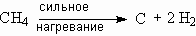§7.2 Получение водорода.
В земных условиях водород встречается преимущественно в связанном состоянии. Многие его соединения нам уже известны: Н2О, HCl, HF и т.д. В этих соединениях водород имеет степень окисления +1, поскольку его электроотрицательность (2,2) меньше, чем электроотрицательность кислорода (3,44), хлора (3,16) и фтора (3,98).
 Когда водород уже находится в степени окисления +1, он может отбирать электрон у многих элементов – особенно металлов, которые склонны отдавать электроны. Поэтому способы получения водорода часто основаны на реакции какого-либо металла с одним из соединений водорода, например:
Когда водород уже находится в степени окисления +1, он может отбирать электрон у многих элементов – особенно металлов, которые склонны отдавать электроны. Поэтому способы получения водорода часто основаны на реакции какого-либо металла с одним из соединений водорода, например:
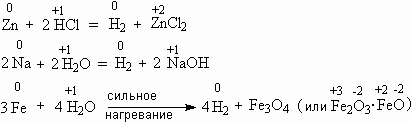
Реакцию между цинком и водным раствором хлористого водорода (соляной кислотой) наиболее часто используют для получения водорода в лаборатории.
А реакция между железом и водяным паром при нагревании имеет историческое значение – когда-то её использовали для наполнения водородом воздушных шаров. Интересные подробности об этом вы можете узнать из трактата начала XIX века, который называется "О разложении воды в весьма огромном снаряде посредством раскаленного железа. Сочинение Якова Захарова".
** Вместо цинка в реакции с HCl можно использовать другие металлы (хотя и не любые) – например, железо, олово, магний. Поэтому получающийся при этом легкий газ когда-то называли "горючим воздухом из металлов". Упоминание о таком "воздухе" есть в сочинениях знаменитого алхимика Иоганна Парацельса, жившего в XVI веке.
Англичанин Роберт Бойль, наблюдавший выделение газа при растворении железных опилок в соляной кислоте, дал ему в 1671 году еще более поэтичное название
– летучая сера Марса. "Летучей серой" Бойль назвал этот газ потому, что наблюдал его горение, а "серой Марса" – потому, что считал его выходящим из железа, символом которого был Марс – бог войны.
Вероятно, многие исследователи еще до XVIII века имели дело с этим элементом, но просто не догадывались о том, что полученный ими газ имеет какое-то отношение к воде. Первым это выяснил английский физик и химик Г. Кавендиш, который в 1766 году всесторонне исследовал "горючий воздух" и убедился в том, что это вовсе не воздух, а совершенно особый газ.
Кавендиш взвесил этот газ, что потребовало большого искусства и определил
– во сколько раз он легче воздуха. Именно Кавендиш, сжигая полученный газ в кислороде, нашел объемы, в которых эти газы реагируют между собой и доказал, что в результате такого сжигания получается вода.
Современное имя водороду дал знаменитый французский химик Лавуазье, придумав латинское название "hydrogen" из слов "hydro" (вода) и "genes" (рождающий).
Движущей силой подобных реакций получения водорода является не только стремление металлов отдать электрон атому Н в степени окисления +1, но и большой энергетический выигрыш при связывании образующихся при этом нейтральных атомов водорода в молекулу Н2. Поэтому в реакции такого типа вступают даже неметаллы:
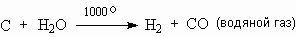
Эта реакция – промышленный процесс. Водяной пар пропускают над раскаленным добела коксом (углем, нагреваемым без доступа воздуха). В результате получается смесь оксида углерода с водородом, которую называют "водяным газом".
Водород может получаться и при сильном нагревании метана:
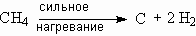
Поэтому в промышленности большое количество водорода получают именно из метана, добавляя к нему при высокой температуре перегретый водяной пар:
1) CH4 + H2O = CO + 3 H2
2) CO + H2O = CO2 + H2
В сумме этот процесс можно записать уравнением:
CH4 + 2 H2O = 4 H2 + CO2
Смесь газов охлаждают и промывают водой под давлением. При этом СО
2 растворяется, а малорастворимый в воде водород идет на промышленные нужды.
 Наиболее чистый водород в промышленности получают электролизом воды:
Наиболее чистый водород в промышленности получают электролизом воды:

** При электролизе атом водорода Н (+1) принимает 1 электрон с отрицательного электрода, превращаясь в водород со степенью окисления (0), а атом кислорода О (-2) отдает 2 электрона положительно заряженному электроду, также превращаясь в атомарный кислород. Атомов водорода в 2 раза больше, поэтому электронный баланс обеспечен.
Этот способ требует больших затрат энергии, поэтому распространен меньше, чем высокотемпературная реакция кокса или метана с водой. Существуют и другие способы получения водорода.
Задачи.
7.2. Сколько граммов цинка нужно взять для реакции с соляной кислотой HСl, чтобы получить 1,12 л водорода при нормальных условиях?
7.3. Между собой прореагировали 23 г Na и 1018 мл воды. Сколько граммов NaOH растворено в 1л полученного раствора? Сколько литров водорода (при н.у.) выделилось?
7.4. Сколько литров водорода (при н.у.) теоретически можно получить в реакции 448 л метана CH4 с перегретым паром? Какой объем занимал водород сразу после окончания реакции при давлении 1 атм и температуре 1000 оС?
7.5. В сосуд с водой поместили электроды и некоторое время пропускали постоянный электрический ток. Масса сосуда уменьшилась на 360 г. Сколько литров водорода (при н.у.) было получено в процессе электролиза?
В следующий параграф.
_________________
 Когда водород уже находится в степени окисления +1, он может отбирать электрон у многих элементов – особенно металлов, которые склонны отдавать электроны. Поэтому способы получения водорода часто основаны на реакции какого-либо металла с одним из соединений водорода, например:
Когда водород уже находится в степени окисления +1, он может отбирать электрон у многих элементов – особенно металлов, которые склонны отдавать электроны. Поэтому способы получения водорода часто основаны на реакции какого-либо металла с одним из соединений водорода, например: