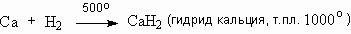
§7.3 Химические свойства водорода. Применение водорода.
Водород – один из рекордсменов по числу многообразия соединений. Наибольшее их количество приходится на соединения с углеродом, которые изучает органическая химия.
Но и неорганические соединения водорода весьма разнообразны. В таблице 6-1 приведены только простейшие соединения водорода с типичными s- и р-элементами.
Таблица 7-1. Примеры соединений водорода с типичными s- и р-элементами. Указана степень окисления водорода во всех соединениях.
|
гидрид лития |
гидрид бериллия |
метан |
аммиак |
вода |
фтористый водород |
|
|
-1 |
-1 |
+1 |
+1 |
+1 |
+1 |
|
|
LiH |
BeH2 |
CH4 |
NH3 |
H2O |
HF |
|
|
тв. |
тв. |
газ |
газ |
жидкость |
газ |
|
гидрид магния |
силан |
фосфин |
сероводород |
хлористый водород |
||
|
-1 |
-1 |
-1 |
+1 |
+1 |
||
|
MgH2 |
SiH4 |
PH3 |
H2S |
HCl |
||
|
тв. |
газ |
газ |
газ |
газ |
|
гидрид кальция |
герман |
арсин |
селеноводород |
бромистый водород |
||
|
-1 |
-1 |
-1 |
+1 |
+1 |
||
|
CaH2 |
GeH4 |
AsH3 |
H2Se |
HBr |
||
|
тв. |
газ |
газ |
газ |
газ |
** Соединения металлов с водородом (они называются гидридами металлов) представляют собой твердые вещества. Гидриды металлов можно получать непосредственно из металла и водорода:
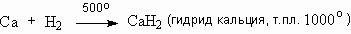
Гидриды бурно реагируют с водой с образованием газообразного водорода:
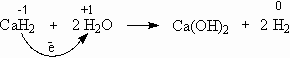
Это еще один удобный способ получения газообразного водорода. Источником водородных атомов являются как гидрид металла, так и вода. Поэтому для получения 1 м3 водорода необходимо всего 0,94 кг гидрида кальция, в то время как для получения того же количества газа действием металлов на кислоты требуется 2,5 кг железа или 2,9 кг цинка.
Соединения водорода с неметаллами в большинстве являются газами. Исключение составляет вода. Такое резкое отличие воды от соседей по таблице 7-1 объясняется существованием между молекулами воды особого вида химической связи
– водородной. Об этом более подробно рассказывается в следующем параграфе.Из всех соединений водорода одним из важнейших является аммиак, который получают реакцией водорода с азотом при высокой температуре, давлении и в присутствии катализатора:

Это один из немногих химических процессов, позволяющих связывать довольно инертный атмосферный азот. В дальнейшем из более активного в химическом отношении аммиака получают множество азотистых соединений
– азотную кислоту, красители, взрывчатые вещества, азотные удобрения. Восстановительные свойства водорода используют для получения чистых металлов из их оксидов. Например, при нагревании оксида меди CuO в токе водорода образуется вода и порошок металлической меди:
Восстановительные свойства водорода используют для получения чистых металлов из их оксидов. Например, при нагревании оксида меди CuO в токе водорода образуется вода и порошок металлической меди:
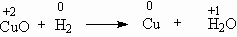
Для некоторых очень тугоплавких металлов восстановление их оксидов водородом оказывается удобным и экономичным способом получения. Например, металл вольфрам, из которого делают нити лампочек накаливания, получают с помощью реакции:
WO3 + 3 H2 = W + 3 H2O
Металл получается в виде порошка, который затем можно прессовать в готовые изделия. После спекания такие изделия не требуют дальнейшей обработки. Этот способ получения металлов и деталей из них называется порошковой металлургией.
 Важной является также реакция горения водорода. Можно ожидать, что реакция водорода с таким хорошим окислителем, как кислород, протекает с большим выделением энергии. Это действительно так. Приведем количество энергии, образующейся при сжигании 1 кг различных топлив, включая водород:
Важной является также реакция горения водорода. Можно ожидать, что реакция водорода с таким хорошим окислителем, как кислород, протекает с большим выделением энергии. Это действительно так. Приведем количество энергии, образующейся при сжигании 1 кг различных топлив, включая водород:
Водород 110 000
– 130 000 кДжБензин 45 000
– 43 000 кДжУголь 33 000 кДж
Дрова 10 000 кДж
Таким образом, водород является чрезвычайно теплотворным химическим топливом. Кроме того, при сжигании водорода образуется только вода, в то время как другие топлива загрязняют атмосферу оксидами углерода, азота и несгоревшими остатками топлива.
Водород используется в качестве горючего в современной ракетной технике. Российская ракета-носитель "Энергия" выводила на орбиту более 100 тонн различных грузов благодаря водородно-кислородным двигателям. В ее двигателях использовались жидкий кислород и жидкий водород.

 Вы уже знаете, что смеси водорода с кислородом называются гремучим газом и взрываются от малейшей искры. Поэтому работа с водородом в качестве топлива требует таких мер предосторожности, которые бы исключали возможность взрыва. Современная техника позволяет достичь высокого уровня безопасности, но история знает трагедии, связанные со взрывами водорода.
Вы уже знаете, что смеси водорода с кислородом называются гремучим газом и взрываются от малейшей искры. Поэтому работа с водородом в качестве топлива требует таких мер предосторожности, которые бы исключали возможность взрыва. Современная техника позволяет достичь высокого уровня безопасности, но история знает трагедии, связанные со взрывами водорода.
В первой половине века в разных странах было построено большое количество летательных аппаратов легче воздуха – дирижаблей.
 Дирижабли – это управляемые аэростаты с сигарообразной оболочкой, наполненной водородом. Большой объем водорода в оболочке обеспечивал высокую грузоподъемность этих воздушных кораблей. На снимке вы видите один из первых дирижаблей небольшого размера, но крупнейшие пассажирские дирижабли 30-х годов XX века могли перевозить до 100 человек на очень большие расстояния. На этих летательных аппаратах были комфортабельные каюты, рестораны, душевые, прогулочные палубы и т.д. Такие дирижабли совершали регулярные рейсы из Европы в Америку.
Дирижабли – это управляемые аэростаты с сигарообразной оболочкой, наполненной водородом. Большой объем водорода в оболочке обеспечивал высокую грузоподъемность этих воздушных кораблей. На снимке вы видите один из первых дирижаблей небольшого размера, но крупнейшие пассажирские дирижабли 30-х годов XX века могли перевозить до 100 человек на очень большие расстояния. На этих летательных аппаратах были комфортабельные каюты, рестораны, душевые, прогулочные палубы и т.д. Такие дирижабли совершали регулярные рейсы из Европы в Америку.
Однако большое количество энергии, выделяющееся в реакции водорода с кислородом, таит в себе огромную опасность. 6 мая 1937 года крупнейший в мире пассажирский дирижабль "Гинденбург", прилетевший из Германии в Нью-Джерси (США), взорвался и рухнул на землю от искры, проскочившей между причальной мачтой и корпусом дирижабля. На фотографии ниже запечатлен этот трагический момент. Во многом именно из-за этой катастрофы строительство пассажирских дирижаблей вскоре прекратилось.

В настоящее время водород не применяют для наполнения аэростатов и других летательных аппаратов легче воздуха. Для этих целей используют более дорогой, но зато безопасный газ гелий.
Задачи.
7.6. Требуется получить 159 г меди из оксида меди CuO. Сколько граммов воды необходимо разложить электролизом, чтобы получить водород для проведения этого превращения?
7.7. Вольфрам – редкий и дорогой металл, используемый при изготовлении нитей для лампочек накаливания. Высокие требования к чистоте вольфрама заставляют получать его восстановлением оксида WO3 таким относительно дорогим восстановителем, как водород. Если получать водород реакцией железа с серной кислотой Fe + H2SO4 = H2 + FeSO4, то сколько потребуется железа и серной кислоты для получения 100 кг вольфрама?
** 7.8 (НГУ). Напишите формулы всех известных вам соединений водорода с элементами 2-го периода. Найдите среди них те, которые реагируют между собой и напишите уравнения реакций.
** 7.9. С помощью каких химических реакций можно получить аммиак NH
3 из метана CH4? Напишите схему превращения и рассчитайте, сколько молей аммиака можно теоретически получить из 1 моля метана._________________