ЗАДАЧИ К ГЛАВЕ 8
8.28. К какому классу (или классам) относятся перечисленные соединения: Na2O, CO2, CuO, SO3, Fe2O3? С какими из них будет реагировать концентрированная серная кислота? Напишите уравнения реакций.
8.29. Если хранить щелочи (NaOH, KOH) в неплотно закрытых банках, то с веществами постепенно происходят изменения, связанные с контактом этих веществ с углекислым газом CO2. Напишите уравнения происходящих реакций.
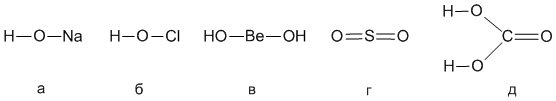
8.30. Ниже приведены структурные формулы пяти веществ. К каким классам соединений относятся эти вещества? Напишите реакции между веществами (а) и (г); между веществами (а) и (б); между веществами (а) и (д).

8.31. Напишите уравнения получения оксидов нагреванием следующих веществ: а) Ca(OH)
2, б) H3PO4, в) Ca3(PO4)2.8.32. Нарисуйте структурную формулу сульфата алюминия Al
2(SO4)3.8.33. В результате реакции между растворами двух солей образовался осадок хлорида серебра, а в растворе остался только нитрат калия. Между какими солями произошла реакция?
8.34. Из двух приведенных ниже уравнений реакций продолжить можно только одно. Какое? Что образуется?
Ni + MgCl2 =
Mg + NiCl2 =
8.35. Из двух приведенных ниже реакций идет только одна. Какая? Напишите уравнение реакции.
FeCl3 + NaOH =
NaCl + KOH =
** 8.36. На титрование 5,0 мл раствора соляной кислоты неизвестной концентрации израсходовано 10,0 мл 0,1 М раствора NaOH. Какова концентрация соляной кислоты?
** 8.37. К раствору, содержащему 1 моль серной кислоты, прибавили 1 моль гидроксида натрия, а затем раствор досуха выпарили. Какая соль при этом выделилась? Какова ее масса?
** 8.38 (ФМШ). Через раствор, содержащий 3,2 г гидроксида натрия, пропустили 1,568 л СО
2. Какие соли и в каком количестве образовались?8.39. Однажды Юх проводил эксперименты по измерению электропроводности растворов разных солей. На его лабораторном столе стояли химические стаканы с растворами KCl, BaCl
2, K2CO3, Na2SO4 и AgNO3. На каждом стакане была аккуратно приклеена этикетка. Как вы помните, в лаборатории жил попугай, клетка которого запиралась не очень хорошо. Когда Юх, поглощенный экспериментом, оглянулся на подозрительный шорох, он с ужасом обнаружил, что попугай, грубо нарушая правила техники безопасности, пытается пить из стакана с раствором BaCl2. Зная, что все растворимые соли бария чрезвычайно ядовиты, Юх быстро схватил со стола стакан с другой этикеткой и насильно влил раствор в клюв попугаю. Попугай был спасен. Стакан с каким раствором был использован для спасения попугая?8.40. Как осуществить следующие превращения:
Ca → Ca(OH)2 → CaCO3 → CaO → CaSO4 → CaCl2 → Ca ?
** 8.41. Как осуществить следующие превращения:
Фосфор → хлорид фосфора (V) → хлороводород → хлорид цинка → хлорид серебра?
** 8.42 (НГУ). При взаимодействии хлорида фосфора PCl
5 с водой образовалось 2,5 моля хлористого водорода. Рассчитайте массу осадка, образующегося при добавлении к полученному раствору избытка CaCl2.** 8.43 (НГУ). Напишите уравнения реакций, происходящих при сливании равных объемов следующих растворов:
а) 1M NH3 + 1M HCl
б) 1M NaOH + 1M H
2SO4в) 1M NaOH + 1M NaHCO
3г) 1M MgCl
2 + 1M NaOHНазовите вещества, которые получаются при осторожном испарении воды из этих растворов. К какому классу они относятся? Напишите их структурные формулы.
** 8.44 (НГУ). Укажите состав конечных продуктов, назовите их и расставьте коэффициенты в следующих уравнениях:
H2S + Pb(NO3)2 =
Cu + HNO3
(конц.) =CuSO4 + Zn =
Na2CO3 + HCl =
Опишите внешние признаки этих реакций.
** 8.45 (НГУ). Приведите структурные формулы угольной кислоты и ее солей (с названиями). Напишите уравнения реакций, отражающие свойства угольной кислоты и ее солей. В чем отличие этой кислоты от других минеральных кислот? Укажите не менее трех способов получения солей угольной кислоты. Какие минералы, являющиеся солями угольной кислоты, вы знаете?
** 8.46 (НГУ). К водному раствору, содержащему 26,4 г сульфата аммония, добавляют избыток гидроксида натрия и нагревают. Выделившийся при этом газ полностью поглощается 100 мл раствора 4М фосфорной кислоты с плотностью 1,2 г/см
3. Определите состав образующейся соли и ее концентрацию (масс. %) в полученном растворе.** 8.47 (НГУ). После выдерживания цинковой пластинки массой 80 г в растворе Pb(NO
3)2 ее масса увеличилась до 94,2 г. Сколько граммов свинца выделилось на пластинке?** 8.48 (НГУ) Напишите уравнения реакций следующих превращений:
Ca → CaH2 → Ca(OH)2 → Ca(HCO3)2 → CaCl2 → Ca3(PO4)2
** 8.49 (НГУ). Минерал изумруд содержит следующие элементы: Be - 5,0 масс. %, Al - 10,0 масс. %, Si - 31,0 масс. %, которые находятся в нем в виде оксидов. Хром, ответственный за зеленую окраску изумруда, содержится в нем в незначительных количествах и его можно не принимать в расчет. Напишите химическую формулу изумруда.

_________________