§10.1. Сильные и слабые электролиты. Константа и степень диссоциации.
В этой главе речь пойдет прежде всего о водных растворах. Неводные растворы, т.е. растворы веществ в бензоле, спирте, эфире, ацетоне и многих других жидкостях, отличных от воды, тоже важны, но их рассмотрение мы отложим до начала изучения органической химии. Пока надо лишь не забывать о том, что многие свойства водных растворов связаны с конкретными свойствами воды как растворителя и неприменимы к неводным растворам.
В §7.6 первой книги вы уже познакомились с тем, как и почему происходит растворение. Одним из важнейших факторов растворимости являются силы межмолекулярного взаимодействия возникающие между частицами растворенного вещества и молекулами растворителя (вспомните §3.8 и §7.4). В ряде случаев действие этих сил приводит к тому, что дробление веществ на мельчайшие частицы в растворе идет дальше и растворение сопровождается диссоциацией молекул на ионы. Например:

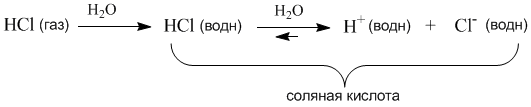
Представьте, что газообразный хлористый водород попадает в воду и начинает взаимодействовать с молекулами растворителя. При этом молекулы HCl связываются с молекулами воды силами межмолекулярного взаимодействия. Обобщенно такой процесс называется гидратацией, а связанные с HCl молекулы воды – гидратной оболочкой.
В случае с раствором хлороводорода (соляная кислота) дальнейшая гидратация молекул HCl приводит к разрыву связи H–Cl и образованию в растворе гидратированных подвижных ионов H+(водн) и Cl–(водн). Ионы несут электрический заряд – положительный и отрицательный. Раствор, в котором теперь присутствуют подвижные ионы, становится электропроводным. Поэтому процесс распада вещества в растворе на ионы называется электролитической диссоциацией.
Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы.
 Посмотрите опыт «Испытание веществ на электрическую проводимость» из Единой коллекции цифровых образовательных ресурсов. По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Посмотрите опыт «Испытание веществ на электрическую проводимость» из Единой коллекции цифровых образовательных ресурсов. По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты.
Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H+ и Cl–. Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота).
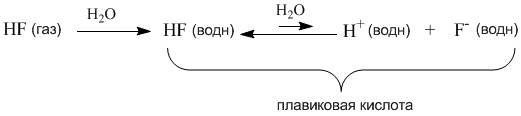
Однако вполне похожее соединение – фтороводород HF – не проявляет свойств сильного электролита и в растворе ток проводит плохо. Здесь, наоборот, в уравнении диссоциации нужна более длинная обратная стрелка:
Мы видим, что наряду с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд:

Маленький индекс (в) означает «водный» – т.е. молекулы и ионы находятся в водном растворе. Часто его не пишут, полагая, что и так все понятно.
Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H+ и Cl– в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало.
Напротив, Кд фтороводорода намного меньше единицы (ее значение уже можно определить более точно – см. следующий параграф). Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H+ и F–.

Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества.
** Теорию электролитической диссоциации в 80-х годах XIX века предложил выдающийся шведский химик Сванте Аррениус (1859-1927). Сегодня нам кажется вполне естественным, что растворенные вещества могут распадаться на ионы. Мы знаем, почему устойчивы именно такие, а не другие ионы – это знание опирается на современные представления о строении атомов. Например, элемент Na (электронная оболочка 1s2 2s2 2p6 3s1) может существовать в виде устойчивого катиона Na+, имеющего уже электронную оболочку чрезвычайно стабильной частицы – атома инертного газа неона (1s2 2s2 2p6). В отличие от нейтрального атома неона, заряженная частица Na+ хорошо взаимодействует с молекулами полярного растворителя – воды. Анион Cl– имеет электронную оболочку инертного газа аргона (…3s2 3p6). Таким образом, на процесс диссоциации влияет не только взаимодействие ионов с растворителем, но и фактор устойчивости самих ионов.
Однако в конце XIX века о строении атомов ничего не было известно и многие ученые не поняли и не приняли теорию Аррениуса. Уязвимым местом теории была и ее неспособность объяснить, какие именно силы обеспечивают разделение прочно связанных в соединениях атомов при растворении. Удивительно, но одним из наиболее непримиримых противников теории электролитической диссоциации был Д. И. Менделеев, развивавший химическую теорию растворов. Он полагал, что при растворении веществ происходит их соединение с молекулами растворителя, в то время как теория Аррениуса отводила растворителю лишь роль некой пассивной среды, не влияющей на свойства раствора. Критика теории электролитической диссоциации Менделеевым не могла не вызвать резкой отрицательной реакции у Аррениуса – одну из своих статей он назвал «Электролитическая диссоциация против гидратации» (1889 г). Интересно то, что каждый из оппонентов был по-своему прав: сегодня мы знаем, что вещества-электролиты в водных растворах диссоциируют на гидратированные ионы, и именно энергия гидратации расходуется на разрушение связей в веществе при его растворении и диссоциации. В 1903 году С. Аррениусу была присуждена Нобелевская премия с формулировкой: «в признание выдающихся заслуг в развитии химии, достигнутых теорией электролитической диссоциации».
Интересен и такой вопрос – надо ли в свете современных представлений называть электролитической диссоциацией переход ионов в раствор при растворении ионных кристаллов – таких как NaCl?
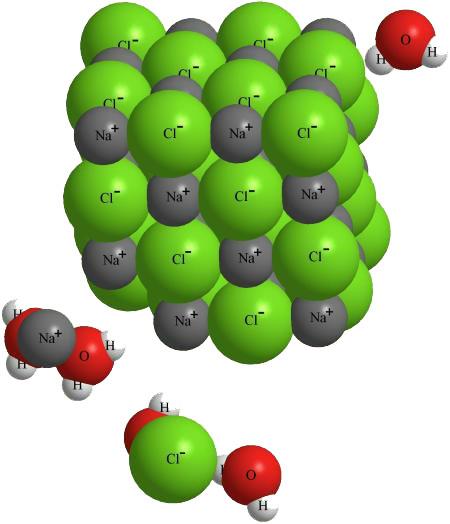
Рис. 10-1. Модель кристалла NaCl, подвергающегося растворению в воде. В действительности в растворе с ионами взаимодействует большее количество молекул воды. Гидратные оболочки ионов могут по разным оценкам насчитывать от нескольких единиц до нескольких десятков молекул Н2О. Если бы мы попытались изобразить гидратную оболочку полностью, ионы просто не были бы видны под «шубой» из молекул растворителя.
В современной химической литературе можно встретить мнение, что термин «электролитическая диссоциация» устарел. Вот цитата из очень хорошей и полезной книги (С. С. Бердоносов, Е. А. Менделеева «Химия. Новейший справочник», М.: «Махаон», 2006):
«После внедрения в 20-е годы прошлого века в исследовательскую практику рентгеновских методов удалось выяснить внутреннее строение твердых веществ. Оказалось, что соединения с ионным характером связи состоят не из отдельных молекул, а из ионов. При растворении в воде эти ионы (катионы и анионы) за счет тепловых колебаний переходят в раствор. Таким образом, оказалось, что никакого распада «молекул» соединений типа NaCl, KOH или MgSO4 при их растворении в воде нет. Поэтому в настоящее время представления об электролитической диссоциации ионных соединений в водном растворе выглядят архаичными и могут рассматриваться только как представления, отвечающие определенному этапу развития науки. В большинстве зарубежных учебников по химии нет разделов, посвященных «теории электролитической диссоциации», а рассматриваются особенности поведения веществ в растворах».
Действительно, можно согласиться с авторами «Новейшего справочника» в том, что процессы растворения и диссоциации ионного кристалла – это, по сути, одно и то же. В таких случаях, как советовал еще в XIII веке богослов и философ Уильям Оккам, «не следует создавать сущностей без необходимости» – иными словами, не следует вводить в научный обиход новое понятие (диссоциация) до тех пор, пока наблюдаемые факты можно объяснять в рамках уже существующего понятия (растворение). Кстати, этот полезный философский принцип, известный в науке как «бритва Оккама», назван так потому, что позволяет «отсекать» все лишнее при создании новых теоретических моделей.
И все же, если рассматривать не только ионные соединения, без термина «электролитическая диссоциация» в современной химии не обойтись. Соединения с полярными ковалентными связями, распадающиеся в растворе на подвижные ионы, состоят из полярных молекул, в составе которых ионов нет. Здесь процессы растворения и диссоциации разделены – в растворе существуют как гидратированные молекулы полярных ковалентных соединений (например, HNO3, Н3РО4, HCl, HF, HCN, CH3COOH и т.д.), так и гидратированные ионы, на которые эти соединения диссоциируют.
Помимо константы диссоциации, мерой силы электролита может служить степень диссоциации α. Это отношение числа распавшихся на ионы молекул (n1) к общему числу молекул (n0), изначально попавших в раствор:
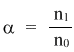
Если речь идет не о молекулярных, а ионных соединениях, то понятие «молекула» следует заменить понятием «формульная единица» (например, NaCl). Допустим, в опыте установлено, что при растворении в воде уксусной кислоты CH3COOH только одна из каждых 100 молекул распадается на ионы Н+ и CH3COO–.
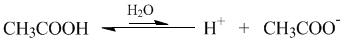
Это означает, что степень диссоциации уксусной кислоты в растворе составляет примерно 1/100 или 0,01. Можно α выразить и в процентах (1%). На основании степеней диссоциации удобно разделять все электролиты на сильные и слабые:
сильные электролиты – α близка к 1 (или 100%),
слабые электролиты – α около 0,01 (1% и менее).
Такое деление условно, но оно очень удобно для написания ионных уравнений химических реакций: достаточно принять за правило, что только сильные электролиты можно записывать в ионном виде, а слабые – нет. Более подробно об ионных уравнениях и о том, как запомнить перечень сильных электролитов, мы расскажем в §10.3.
Поскольку вода – полноправный участник процесса диссоциации, ее иногда включают в химическое уравнение. Например, для уксусной кислоты процесс ее диссоциации в воде можно записать так:

Такие уравнения как бы подчеркивают, что ионы в водном растворе не изолированы, а связаны с молекулами растворителя. Для иона Н+ это взаимодействие очень характерно: благодаря его связыванию с неподеленной электронной парой атома кислорода молекулы Н2О образуется достаточно прочный комплекс Н2О---Н+ или, как его условно называют, ион гидроксония Н3О+. Конечно, молекулы воды взаимодействуют и с анионом CH3COO– (и любыми другими анионами), но это обстоятельство в уравнениях диссоциации обычно не отражают просто по традиции (и чтобы не загромождать уравнения).
Поскольку к процессу диссоциации применим принцип Ле Шателье, последнее уравнение указывает нам на еще одну важную закономерность: если разбавлять раствор уксусной кислоты, т.е. добавлять в него воду, то по принципу Ле Шателье должен активизироваться процесс, связанный с расходованием воды, т.е. прямая реакция (распад на ионы). В этом случае в растворе должен активизироваться процесс образования ионов из молекул. Иными словами, при разбавлении растворов слабых электролитов степень диссоциации возрастает. О том, как эта закономерность выражается количественно, рассказывается в следующем параграфе.
ЗАДАЧИ
10.1. Напишите уравнения диссоциации и выражения для констант диссоциации в растворах: а) азотистой кислоты HNO2, б) гидроксида лития LiOH, в) хлорноватистой кислоты HClO.
10.2. В 1 л воды растворили 20 г щелочи NaOH. Рассчитайте (с точностью до целого числа), сколько молекул воды приходится на каждый ион в полученном растворе. Примечание: будем считать, что α = 1.
10.3. Однажды в химическом форуме один школьник написал: «а я ваще не понимаю (именно так было написано) почему NaCl в растворе распадается на Na+ и Cl–, а не на Na– и Cl+». Как бы вы объяснили бедолаге суть происходящего в растворе? Какой важный раздел химии в свое время «прогулял» наш незадачливый школьник?
10.4. Ниже приведены кадры видеоопыта «Испытание веществ на электрическую проводимость» из Единой коллекции цифровых образовательных ресурсов (ссылка на него дана в начале параграфа).



Какие серьезные нарушения правил работы в лаборатории вы здесь увидели? В чем заключаются конкретные опасности и как они связаны со свойствами электролитов?
_________________