§10.2.** Зависимость степени диссоциации от концентрации. Закон разбавления Оствальда.
В предыдущем параграфе мы качественно, на основе принципа Ле Шателье установили, что разбавление раствора должно приводить к увеличению степени диссоциации α. Но эту взаимосвязь можно выразить и количественно.
Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, αС = [X+] моль/л, и αC = [Y–] моль/л.
Если электролит сильный (α = 1), концентрация каждого из ионов просто равна исходной концентрации электролита. Например, в 1 литре 0,1 М раствора NaCl содержится 0,1 моль ионов Na+ и 0,1 моль ионов Cl–.
К физическому смыслу произведения αС можно прийти и другим путем. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы:
HCN ![]() H+ + CN–
H+ + CN–
Напомним, что в выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. Напомним также, что n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H+] и n1 = [CN–]. В этом случае:
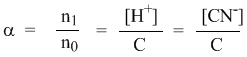
Отсюда следует, что
[H+] = Cα,
[CN–] = Cα.
Итак, мы приходим к тому же выводу: чтобы получить концентрацию любого из ионов в растворе, достаточно общую концентрацию вещества С умножить на коэффициент α – степень его диссоциации.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:
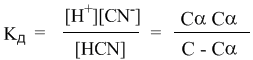
Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:
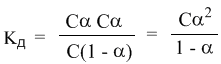
Или, в другой записи:
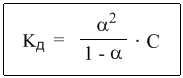
Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.
Однако в случае слабых электролитов величина (1 – α) очень мало отличается от единицы. Действительно, если α = 0,01, то (1 – 0,01) = 0,99, т.е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде:
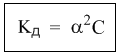
 Константа диссоциации, как и любая константа равновесия, при данной температуре постоянна. Поэтому, если уменьшается концентрация вещества (раствор разбавляют), то для сохранения постоянства константы диссоциации должна возрастать величина α. Посмотрите опыт из Единой коллекции цифровых образовательных ресурсов: при разбавлении концентрированной уксусной кислоты раствор начинает слабо проводить ток (лампочка слегка накаляется). Это означает, что при разбавлении возрастает степень диссоциации слабого электролита. Наоборот, чем концентрирование раствор, тем меньше степень диссоциации α.
Константа диссоциации, как и любая константа равновесия, при данной температуре постоянна. Поэтому, если уменьшается концентрация вещества (раствор разбавляют), то для сохранения постоянства константы диссоциации должна возрастать величина α. Посмотрите опыт из Единой коллекции цифровых образовательных ресурсов: при разбавлении концентрированной уксусной кислоты раствор начинает слабо проводить ток (лампочка слегка накаляется). Это означает, что при разбавлении возрастает степень диссоциации слабого электролита. Наоборот, чем концентрирование раствор, тем меньше степень диссоциации α.
Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10–5. Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α2С. Отсюда:
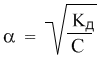
Подставляя в эту формулу численные значения, получим:
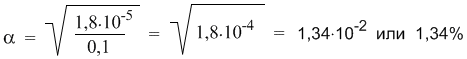
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
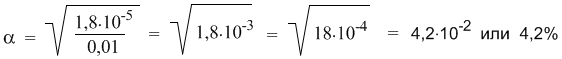
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Рекомендуем решить приведенные ниже задачи на разбавление растворов – они тоже дают представление о сфере применимости только что рассмотренного закона.
ЗАДАЧИ
10.5. **(ФМШ). Сколько воды надо прибавить к 300 миллилитрам 0,2 М раствора уксусной кислоты СН3СООН (Кд = 1,8·10–5), чтобы степень диссоциации кислоты удвоилась?
10.6. **(ФМШ). Сколько воды надо прибавить к 200 мл 0,27 М раствора муравьиной кислоты НСООН (Кд = 1,8·10–4), чтобы степень диссоциации увеличилась в 3 раза?
Подсказка к задаче 10.5. Эта задача проще, чем может показаться на первый взгляд. Численное значение константы диссоциации кислоты при решении вам не потребуется. В задаче оно приведено для того, чтобы было понятно, что кислота слабая и к ее растворам применим закон разбавления Оствальда в виде: Кд = α2С. По условию задачи степени диссоциации после разбавления и до разбавления соотносятся как α2 = 2α1. Если выразить обе α через закон разбавления, то при дальнейшем решении значения Кд сокращаются. Есть способ решения, в котором значение концентрации раствора 0,2 М тоже не обязательно использовать (напомним, что большая буква «М» означает «моль/л»). Попробуйте найти это решение.
_________________